【化学整理】氢键的影响
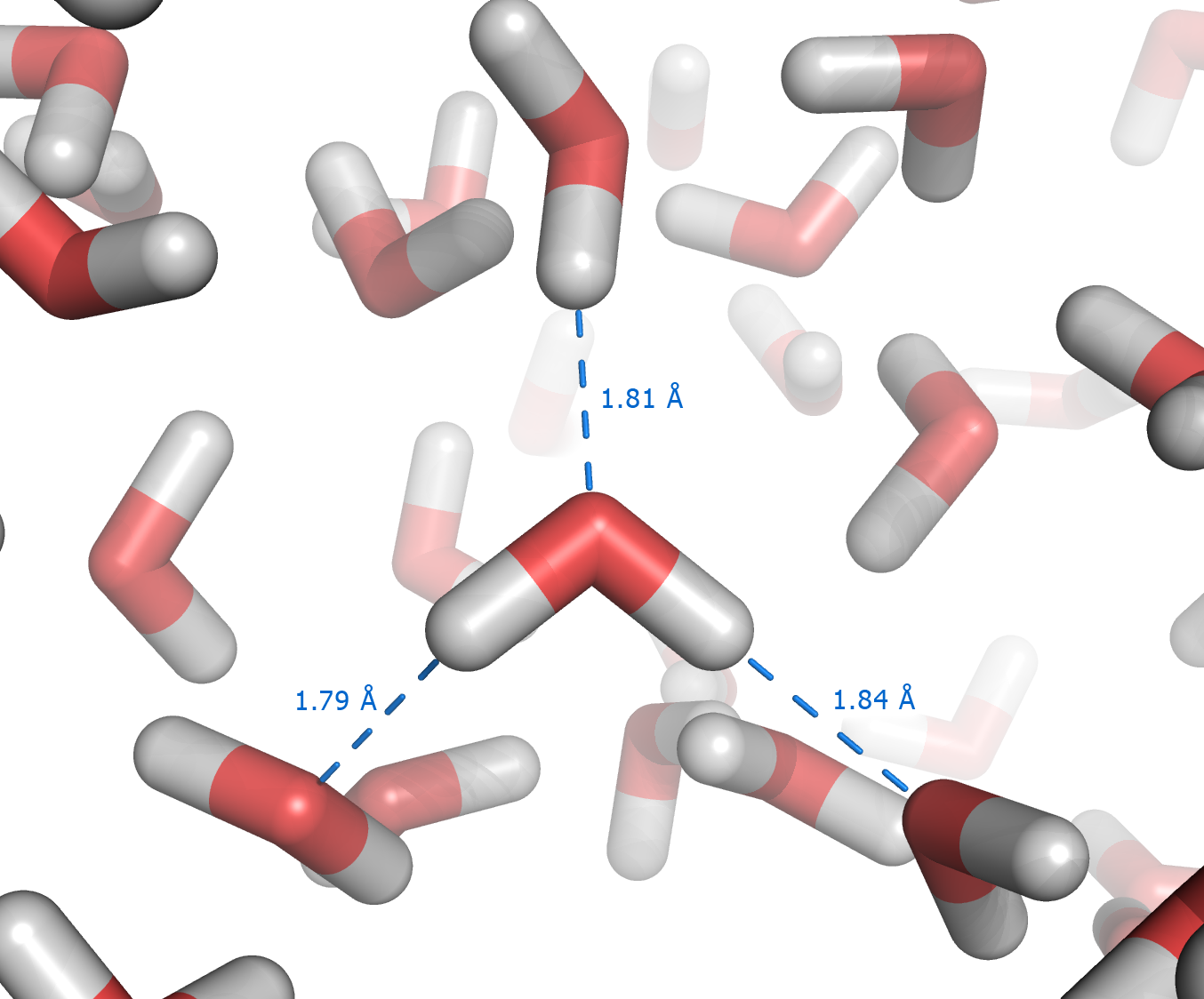 |
| 液态水模拟图。照片中心的分子引出的的蓝色虚线代表氢键。 |
·
与同族的化合物相比,NH3、H2O和HF具有反常高的熔点和沸点。
·
氨在水中的非常大的溶解度与它和水分子间的氢键有关。
·
甘油、无水磷酸和硫酸具有较大的黏度。
·
邻硝基苯酚中存在分子内氢键,因此熔点较间硝基苯酚和对硝基苯酚低。
·
冰中水分子在冰晶体结构中空间占有率较低,因而冰密度较小,甚至小于水。
o 冰中每个H2O水分子都按四面体方向参与形成4个O-H…O氢键,每摩尔冰中只有2N0个氢键。冰的熔化热为5.0kJ/mol,而冰中氢键键能为18.8kJ/mol,因此刚熔化的水中仍有大量的氢键。在4℃时,水氢键断裂(密度增大)和受热分子间距增大(密度减小)的趋势相等,因此4℃时水密度最大。这个温度对于水中生物至关重要,它保证了冬季时水中生物不至于因为水结冰而死亡。
·
分子内形成氢键常使酸性增强。如苯甲酸的Ka=96.2×10﹣¹²,而邻羟基苯甲酸的Ka=9.9×10-¹¹,2,6-二羟基苯甲酸可在分子内形成两个氢键,它的Ka=5×10﹣9。其原因是分子内氢键的形成,促进了氢的解离。
·
结晶水合物中存在由氢键构建的类冰骨架,其中可装入小分子或离子。【甲烷气水包合物】。
·
C=O…H-N氢键使蛋白质形成α螺旋。
·
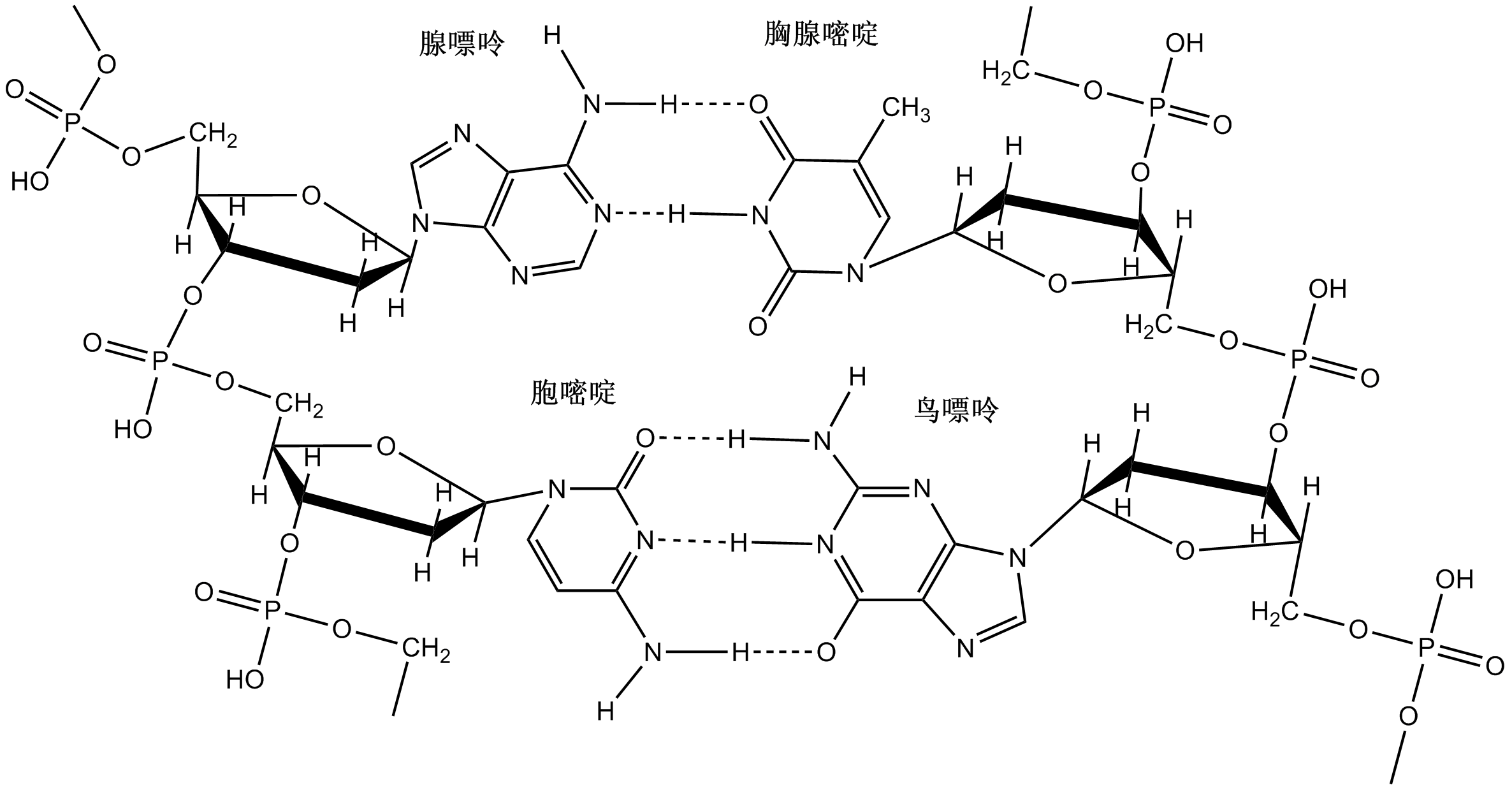
DNA(脱氧核糖核酸)中两条链的碱基通过氢键配对,而氢键的饱和性和方向性使得双螺旋的碱基配对具有专一性,即A-T靠2个氢键配对而C-G靠3个氢键配对,如下图:


评论
发表评论