【化学整理】化学键对物质熔沸点的影响
物质熔沸点的高低由物质固态时的晶体类型及构成物质的微粒间的作用力决定的。
一般来说,原子晶体的熔沸点最高,离子晶体较高,分子晶体最低。
金属的熔沸点一般较高,但差别较大,按具体情况决定。
由离子键构成的物质(活泼的金属与活泼的非金属,碱、盐等物质,固态时为离子晶体),其熔沸点的高低由离子半径的大小及电荷数的多少决定。
离子半径越小,电荷数越多,则形成的离子键越强,物质的熔沸点也就越高。
例如:NaCl 的熔沸点高于 KCl。
由原子的共价键直接构成的原子晶体,其熔沸点的高低是由共价键的强弱决定的。
原子半径越小即键长越短,键能大,共价键强而熔沸点高。
例如:金刚石的熔点高于晶体硅,而碳化硅的熔点处于金刚石与晶体硅之间。
由分子以分子间作用力构成的分子晶体,其熔沸点高低由分子间作用力大小所决定。
结构和组成相同的物质,分子量越大,其熔沸点越高。
例如:熔沸点:F2 < Cl2 < Br2 <I2。
若分子间存在氢键,分子间作用力强烈。(高中阶段,H 与 N,O,F 之间需要考虑)
例如,沸点:HF > HCl > HBr > HI。
金属晶体的熔沸点是由金属键强弱决定的。
金属离子的半径越小、电荷数越多,则金属键强烈,熔沸点高。
例如,熔沸点:Na < Mg < Al;Li > Na > K > Rb > Cs。
以上是总的概括。
一般来说,原子晶体的熔沸点最高,离子晶体较高,分子晶体最低。
金属的熔沸点一般较高,但差别较大,按具体情况决定。
由离子键构成的物质(活泼的金属与活泼的非金属,碱、盐等物质,固态时为离子晶体),其熔沸点的高低由离子半径的大小及电荷数的多少决定。
离子半径越小,电荷数越多,则形成的离子键越强,物质的熔沸点也就越高。
例如:NaCl 的熔沸点高于 KCl。
由原子的共价键直接构成的原子晶体,其熔沸点的高低是由共价键的强弱决定的。
原子半径越小即键长越短,键能大,共价键强而熔沸点高。
例如:金刚石的熔点高于晶体硅,而碳化硅的熔点处于金刚石与晶体硅之间。
由分子以分子间作用力构成的分子晶体,其熔沸点高低由分子间作用力大小所决定。
结构和组成相同的物质,分子量越大,其熔沸点越高。
例如:熔沸点:F2 < Cl2 < Br2 <I2。
若分子间存在氢键,分子间作用力强烈。(高中阶段,H 与 N,O,F 之间需要考虑)
例如,沸点:HF > HCl > HBr > HI。
金属晶体的熔沸点是由金属键强弱决定的。
金属离子的半径越小、电荷数越多,则金属键强烈,熔沸点高。
例如,熔沸点:Na < Mg < Al;Li > Na > K > Rb > Cs。
以上是总的概括。
共价键主要有两种,一种是 σ 键,一种是 π 键,π 键强度不如 σ 键。
对于离子键,离子半径越小,粒子所带的电荷数越多,离子键就越强,例如:氧化铝 > 氧化镁 > 氧化钠。
对于共价键,则是形成共价键的原子半径越小,则共价键就越强,反之越弱。
刻意强调哪个强烈是无意义的。
共价键的概念
何为共价键呢?
它的本质是原子之间共用电子对(或电子云重叠),因为每一个
它的本质是原子之间共用电子对(或电子云重叠),因为每一个
原子周围都存在这电子,只是电子数的多少不同罢了,它们之间若要形成化合物,就可以通过共用电子对来实现,所以说共价键又可以说是两个相邻原子之间的强烈的相互作用。
根据它们的成键方式可以分为 σ 键和 π 键,它们之间的区分就要看电子云是如何重叠的(电子云就是每个原子存在电子的一个区域),σ 键是电子云“头碰头”,它们成轴对称;而 π 键是电子云“肩并肩”,它们则关于一个平面对称。
请看图:
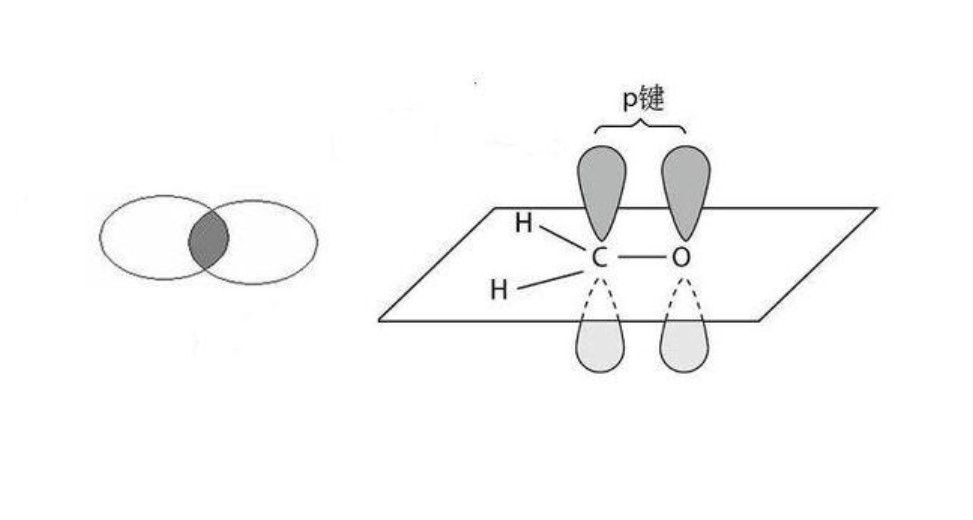

左边是 σ 键, 右边是 π 键。
但请注意,不是所有的原子都可以通过共用电子对来形成化合物,有些是通过离子键,有些是通过金属键等,就要具体问题具体分析了。
【概念】来自高三化学书
首先给出金属晶体的定义:金属离子与自由电子之间存在着较强的作用,使许多金属离子结合在一起,通过金属离子与自由电子之间的较强作用形成的单质晶体,叫做金属晶体。
这种金属离子与自由电子之间的较强作用就叫做金属键。通俗一点来说,单质 Na 可以看作是一种金属晶体,而其中是由多个 Na 离子和自由电子构成。
不过 NaCl 中的 Na 离子并不能代表金属键。
首先给出金属晶体的定义:金属离子与自由电子之间存在着较强的作用,使许多金属离子结合在一起,通过金属离子与自由电子之间的较强作用形成的单质晶体,叫做金属晶体。
这种金属离子与自由电子之间的较强作用就叫做金属键。通俗一点来说,单质 Na 可以看作是一种金属晶体,而其中是由多个 Na 离子和自由电子构成。
不过 NaCl 中的 Na 离子并不能代表金属键。


整理了格式 + 高亮了部分内容
回复删除另请参阅:【化学整理】氢键的影响
回复删除https://ark-joe.blogspot.com/2020/01/effect-of-hydrogen-bonding.html